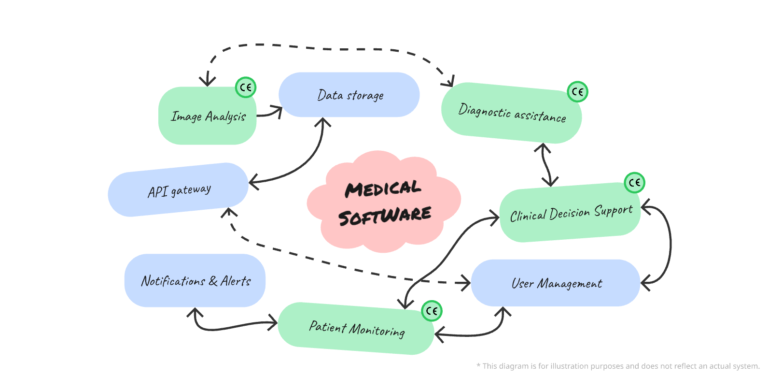
Gestion des fonctionnalités d’un dispositif médical numérique
L’obtention du marquage CE pour un logiciel en tant que dispositif médical (DM) est une étape cruciale pour sa mise sur le marché européen. Cependant, tous les logiciels n’ont pas de fonctionnalités à vocation médicale. La distinction entre fonctionnalités DM et non-DM (non dispositif médical) est essentielle pour garantir la conformité aux exigences du règlement…